2025上半年获批的FDA小分子药盘点,作用机制及关键砌块深度剖析 | 乐研试剂
发表时间:2025-08-192025年上半年,FDA共批准16款创新药物,其中小分子药物占比为56%,达到9款,这表明小分子药物在新药批准中任然占据重要地位。它们不是简单的“新结构”, 而是经过了复杂而严谨的研发、临床试验和审批流程的成果,体现了在药物设计、靶点选择、药代动力学以及安全性评估等多方面的深入研究和优化。每一款小分子药物的获批,都凝聚了科学家们对疾病机制的深刻理解、对药物分子精准设计的努力,以及对临床需求的精准满足。接下来,让我们详细了解这些小分子药物独特的作用机制,以及这些分子背后的关键分子砌块。
Section.01
Suzetrigine (Journavx)
急性疼痛治疗的非阿片类新选择
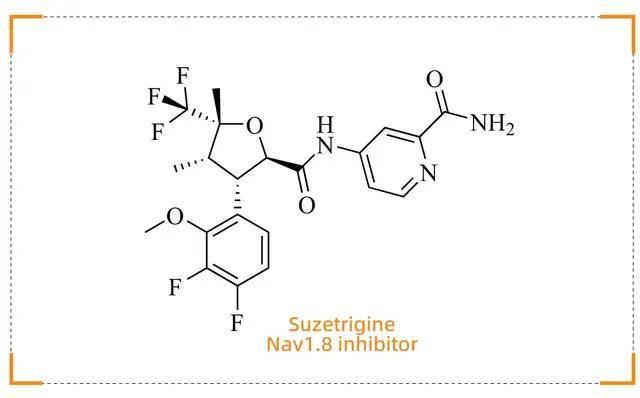
药物背景
Suzetrigine(商品名:Journavx)由 Vertex Pharmaceuticals 开发,于 2025 年 1 月 30 日获得 FDA 批准,用于治疗成人中度至重度急性疼痛。这是 20 多年来首个获批的非阿片类镇痛药物,标志着疼痛管理领域的一个重要里程碑。传统急性疼痛治疗多依赖阿片类药物,但其成瘾性和其他副作用限制了使用。Suzetrigine 的出现为患者提供了一种非成瘾性的有效替代方案。
作用机制
Suzetrigine 是一种口服选择性 Nav1.8 抑制剂,高度选择性地作用于外周神经系统中的 Nav1.8电压门控钠通道。Nav1.8 主要表达在外周感觉神经元上,负责传导疼痛信号。Suzetrigine 通过结合 Nav1.8 的第二个电压感应域(VSDII),稳定通道的关闭状态,阻止钠离子内流,从而抑制动作电位的产生和疼痛信号的传递。这种机制使其能够在不进入中枢神经系统的情况下,有效缓解疼痛,避免了阿片类药物的成瘾性和中枢副作用。
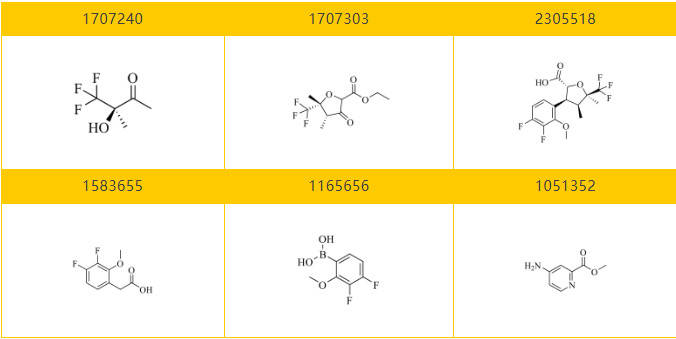
乐研可提供Suzetrigine的关键分子砌块:
Section.02
Mirdametinib (Gomekli)
神经纤维瘤精准治疗的时代突破
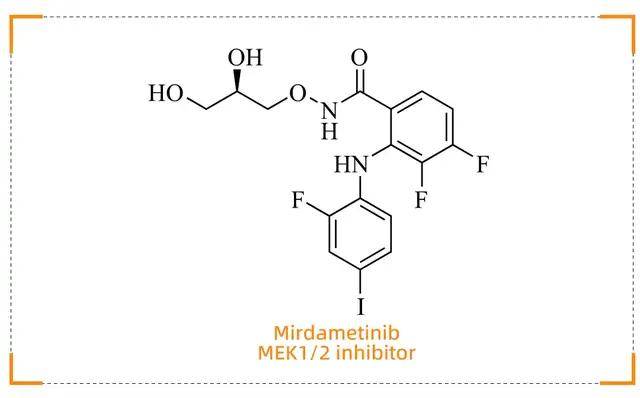
药物背景
Mirdametinib(商品名:Gomekli)由 SpringWorks Therapeutics 开发,于 2025 年 2 月 11 日获得 FDA 批准,是首个专门针对神经纤维瘤1型相关丛状神经纤维瘤(NF1-PN)的口服小分子药物。NF1-PN 是一种罕见的良性肿瘤,传统治疗方法效果有限,该药物的获批为患者带来了新的希望。
作用机制
Mirdametinib 是一种口服别构 MEK1/2抑制剂。NF1 基因突变导致 RAS信号通路过度激活,进而促使MEK-ERK信号传导持续增强,从而推动了丛状神经纤维瘤的形成。Mirdametinib 通过结合 MEK1/2 的别构口袋,抑制ERK的过度磷酸化,从而阻断肿瘤细胞的增殖和生长,为 NF1-PN 患者提供了精准的靶向治疗方案。
乐研可提供Mirdametinib的关键分子砌块:

Section.03
Vimseltinib (Romvimza)
开启腱鞘巨细胞瘤靶向治疗新时代
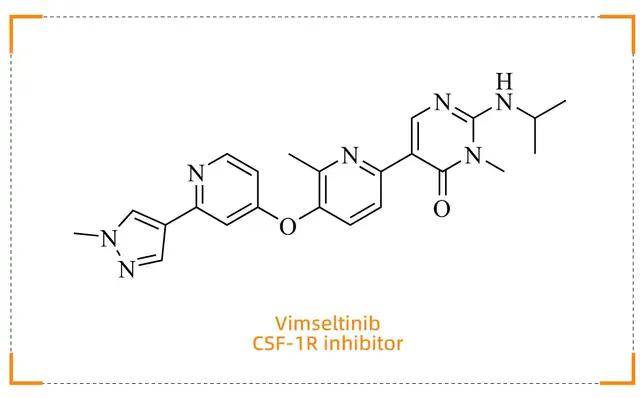
药物背景
Vimseltinib(商品名:Romvimza)由Ono Pharmaceutical开发,于 2025 年 2 月 14 日获得 FDA 批准,用于治疗不适合手术切除的腱鞘巨细胞瘤(TGCT)患者。TGCT 是一种罕见的良性肿瘤,传统治疗方法多为手术切除,但复发率高且可能导致严重功能障碍。Vimseltinib 的获批为患者提供了首个口服靶向治疗选择,避免了手术带来的高风险和不可逆损伤。
作用机制
Vimseltinib 是一种高选择性 CSF-1R(集落刺激因子-1 受体)抑制剂。TGCT 的发生与 CSF-1R过度激活密切相关, Vimseltinib 通过结合CSF-1R的非活性构象,抑制其自磷酸化及下游信号传导,从而减少肿瘤细胞的增殖、存活和迁移,同时诱导肿瘤细胞凋亡。
乐研可提供Vimseltinib的关键分子砌块:
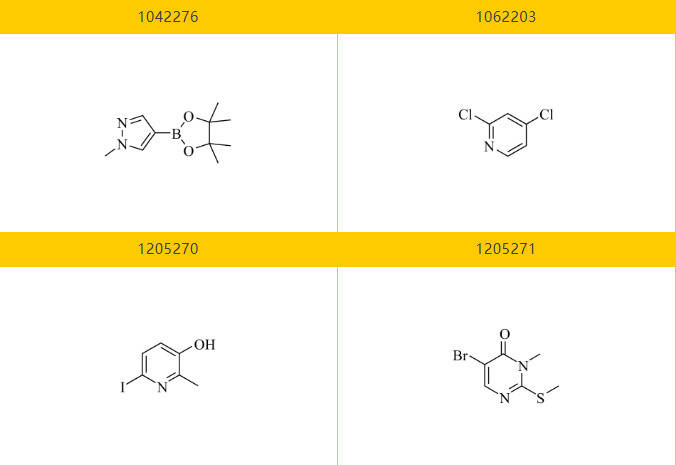
Section.04
Acoltremon (Tryptyr)
干眼症治疗的快速缓解新选择
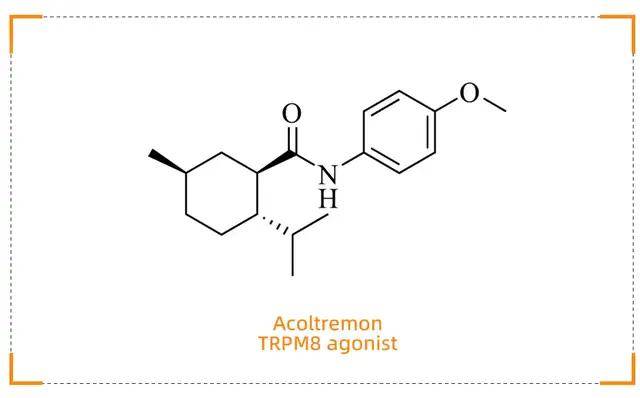
药物背景
Acoltremon(商品名:Tryptyr)由Alcon开发,于2025年5月28日获得 FDA 批准,用于治疗干眼症。干眼症是一种常见的眼部疾病,传统治疗方法效果有限,且起效较慢。Acoltremon 的获批为患者提供了一种快速缓解干眼症状的新选择。
作用机制
Acoltremon是一种 TRPM8 激动剂。TRPM8作为一种冷觉感受器,其激活可触发三叉神经反射,从而促进天然泪液的分泌。具体而言,Acoltremon通过激活角膜上的TRPM8受体,激发三叉神经信号传导,进而刺激基础泪液的分泌。这一机制使得 Acoltremon 能够迅速增加泪液分泌,为干眼症患者提供快速缓解。
乐研可提供Acoltremon的关键分子砌块:

Section.05
Taletrectinib (Ibtrozi)
重塑ROS1阳性肺癌治疗格局
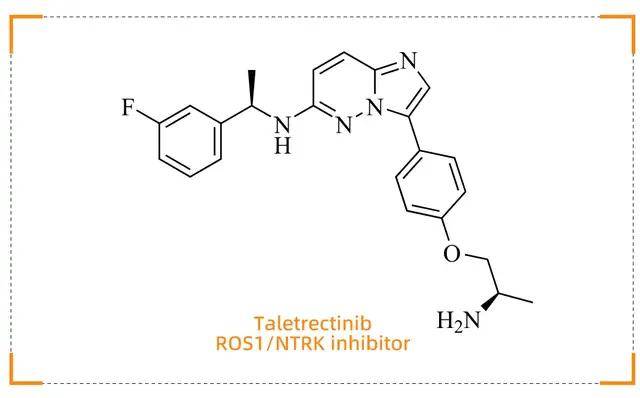
药物背景
Taletrectinib(商品名:Ibtrozi)由Nuvation Bio开发,于 2025 年6月11 日获得 FDA 批准,用于治疗局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)患者
作用机制
Taletrectinib 是一种口服的 ROS1和NTRK 双靶点抑制剂。它通过靶向抑制 ROS1 和NTRK的激酶活性,阻断肿瘤细胞的增殖和生长信号通路。与第一代 ROS1 抑制剂相比,Taletrectinib 具有更好的血脑屏障穿透能力,对中枢神经系统内的肿瘤病灶产生作用,尤其适用于伴有脑转移的ROS1阳性非小细胞肺癌患者。
乐研可提供Taletrectinib的关键分子砌块:
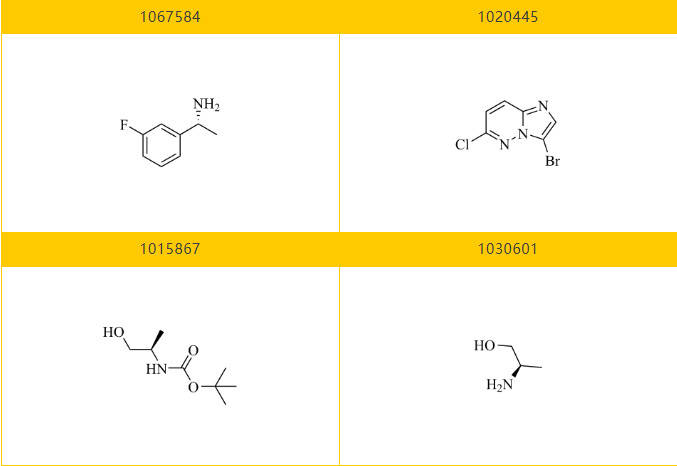
Section.06
Gepotidacin (Blujepa)
单纯性尿路感染治疗的创新突破
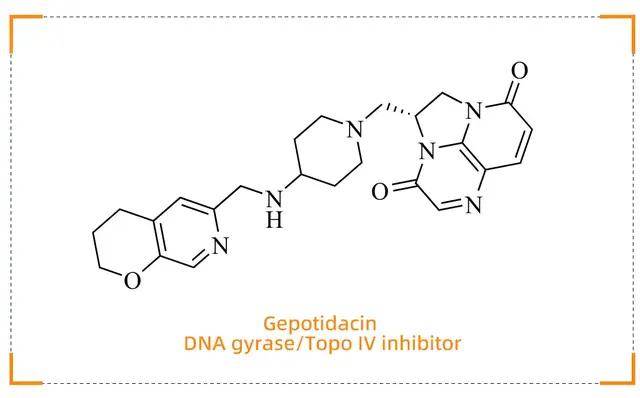
药物背景
Gepotidacin(商品名:Blujepa)由GSK开发,于 2025 年 3 月 25 日获得 FDA 批准,用于治疗由大肠杆菌、肺炎克雷伯菌等易感菌株引起的单纯性尿路感染(uUTI),适用人群为体重≥40kg 的 12 岁以上女性患者。这是 30 多年来首个获批用于治疗 uUTI 的全新类别口服抗生素。
作用机制
Gepotidacin是一种首创的三氮杂苊烯类抗生素,通过独特的作用机制抑制细菌 DNA 复制。它能够均衡抑制细菌 DNA解旋酶和拓扑异构酶,形成“双重枷锁”,从而有效阻断细菌 DNA 复制过程。这种双靶点抑制机制显著提高了耐药屏障,因为病原体需同时对两个靶点产生突变才能对药物产生耐药性。
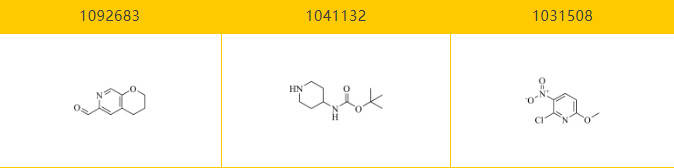
乐研可提供Gepotidacin的关键分子砌块:
Section.07
Atrasentan (Vanrafia)
为肾病治疗带来突破性进展
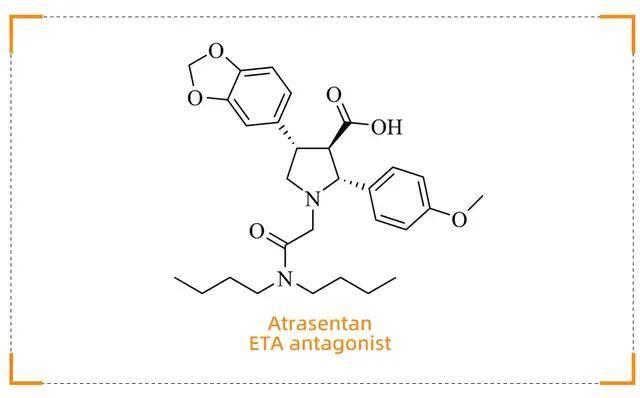
药物背景
Atrasentan(商品名:Vanrafia)由Novartis开发,于2025年4月2日获得 FDA 批准,用于治疗原发性IgA肾病(IgAN)成人患者,这些患者通常表现为尿蛋白与肌酐比值(UPCR)≥1.5 g/g,且有快速疾病进展的风险
作用机制
Atrasentan通过高选择性拮抗内皮素A(ETA)受体发挥作用,其机制核心是阻断内皮素-1(ET-1)与ETA受体的结合,从而抑制ET-1介导的病理过程。ET-1对ETA受体的激活会促进血管收缩、炎症反应和纤维化,导致肾小球硬化、蛋白尿增加和肾功能下降。而Atrasentan通过精准干预这一通路,显著降低患者的蛋白尿,同时延缓肾小球硬化和间质纤维化进展,从而实现其治疗效果。
乐研可提供Atrasentan的关键分子砌块:

Section.08
Avmapki Fakzynja Co-pack(Avutometinib + Defactinib)
KRAS 突变卵巢癌治疗新策略
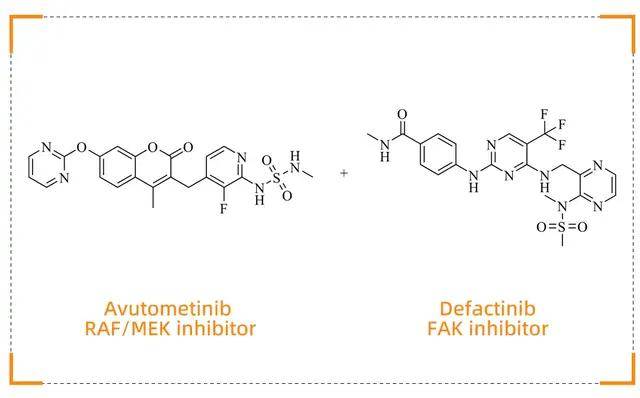
药物背景
Avmapki Fakzynja Co-pack(Avutometinib + Defactinib)是一种新型联合疗法,由 Verastem Oncology 开发,于 2025 年 5 月 8 日获得 FDA 批准,用于治疗携带 KRAS 突变的复发性低级别浆液性卵巢癌(LGSOC)患者。LGSOC 是一种少见的卵巢癌亚型,传统治疗方法效果有限,该药物的获批为患者带来了新的希望。
作用机制
·Avutometinib是一种新型的RAF-MEK双重抑制剂,它同时结合RAF激酶和MEK激酶,,并诱导RAF-MEK形成非活性复合物,从而阻断RAF对MEK的磷酸化。这种双重抑制作用可全面抑制MAPK信号通路,减少肿瘤细胞的增殖和存活。
·Defactinib是一种口服的小分子FAK(黏着斑激酶)抑制剂。FAK是一种非受体酪氨酸激酶,在多种肿瘤中过表达,与肿瘤的生存、生长和转移密切相关。Defactinib通过抑制FAK在Tyr397位点的磷酸化,阻断由整合素介导的下游信号传导通路,从而抑制肿瘤细胞的迁移、增殖、存活以及肿瘤血管生成。
KRAS 突变导致RAS-MAPK信号通路持续激活,促使肿瘤细胞增殖和存活。Avutometinib通过抑制MEK的活性,阻断 RAS-MAPK 信号通路;Defactinib则通过抑制FAK,破坏肿瘤转移微环境并阻断耐药信号传导。这种双靶点组合疗法为 KRAS 突变卵巢癌患者提供了精准的治疗方案。
乐研可提供Avmapki Fakzynja Co-pack的关键分子砌块:
总结
2025年上半年,FDA批准的小分子药物在急性疼痛、肿瘤等领域取得了显著进展,为患者带来了新的治疗选择。这些药物的批准不仅推动了医学进步,还为新药研发人员提供了宝贵经验。未来小分子药物有望在治疗更多疾病、提高患者生活质量、降低医疗成本等方面发挥更大作用,尤其是在精准医疗和个性化治疗领域,小分子药物将占据越来越重要的地位。




